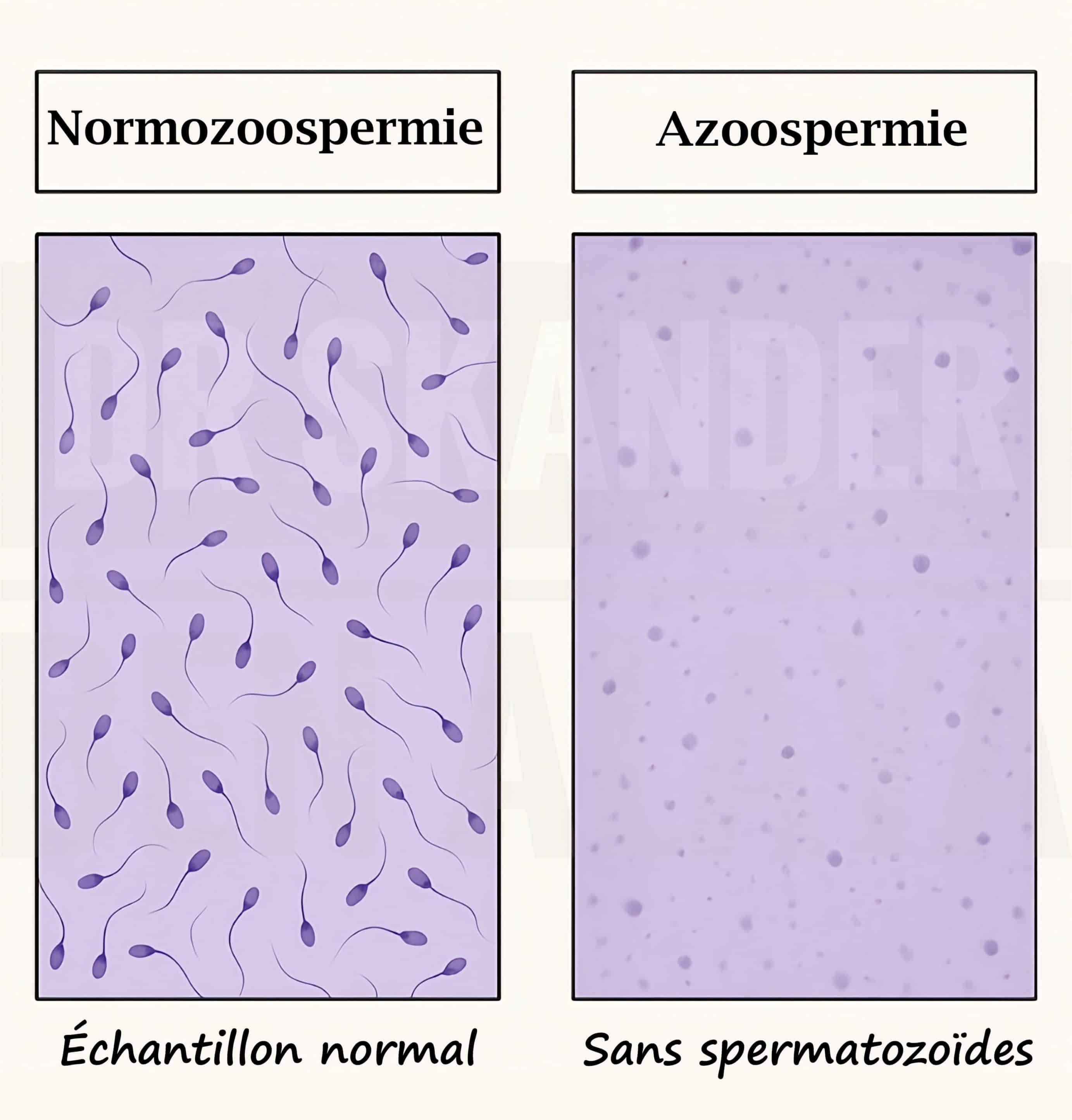
L’azoospermie est caractérisée par l’absence de spermatozoïdes dans le sperme éjaculé. Elle touche 1 % des hommes sur l’échelle mondiale et représente entre 5 et 15 % des étiologies d’infertilité masculine.. Le diagnostic d’azoospermie se fait par une analyse du sperme appelé spermogramme. Le diagnostic positif d’azoospermie repose sur l’analyse sémiologique du sperme, désignée sous le terme de spermogramme. Cet examen andrologique fondamental s’inscrit dans le bilan étiologique exhaustif entrepris face à une infertilité du couple et une prise en charge précoce peut améliorer les chances de procréation.
Spermatogenèse et classification des azoospermies
La spermatogenèse, processus de formation des spermatozoïdes, dure en moyenne 74 jours. et se déroule dans les tubes séminifères testiculaires. Durant ce cycle, les cellules germinales subissent une maturation progressive, transitant par les stades de spermatogonies, spermatocytes (I et II) puis spermatides. Ces dernières subissent une spermatogenèse aboutissant à la formation de spermatozoïdes morphologiquement matures. Les gamètes ainsi formés migrent ensuite vers l’épididyme, où ils acquièrent leur mobilité et capacité fécondante, avant d’être véhiculés via le canal déférent. Lors de l’éjaculation, les spermatozoïdes se mélangent aux sécrétions des glandes annexes, notamment la prostate et les vésicules séminales, constituant le sperme qui est expulsé par l’urètre. Ce processus physiologique essentiel est finement régulé par un axe hypothalamo-hypophyso-testiculaire impliquant trois hormones gonadotropes principales : la testostérone, la lutéinostimuline (LH) et la folliculostimuline (FSH).
L’azoospermie, caractérisée par l’absence de spermatozoïdes dans l’éjaculat, peut résulter d’anomalies survenant à différents niveaux de cette voie. On distingue classiquement deux étiologies majeures :
Azoospermie excrétoire (forme obstructive)
Altération mécanique du tractus génital masculin entraînant une obstruction des voies spermatiques, empêchant l’excrétion des spermatozoïdes normalement produits.
Caractéristiques :
- Spermatogenèse conservée (histologie testiculaire normale).
- Profil hormonal normal (FSH < 8 UI/L, testostérone > 3 ng/mL).
- Volume séminal souvent diminué (<1,5 mL).
Azoospermie sécrétoire (forme non obstructive)
Atteinte primitive ou secondaire de la spermatogenèse testiculaire aboutissant à une production insuffisante ou absente de spermatozoïdes.
- Azoospermie d’origine testiculaire (forme basse) : Atteinte primitive du parenchyme testiculaire, entraînant une élévation réactionnelle des gonadotrophines.
- Azoospermie d’origine hypothalamo-hypophysaire (forme haute) : Atteinte est centrale, avec déficit en gonadotrophines.
Cette distinction est cruciale car les formes centrales peuvent souvent bénéficier d’un traitement hormonal substitutif (hCG + FSH), alors que les formes testiculaires pures relèvent généralement directement des techniques de prélèvement testiculaire en vue d’ICSI.
Diagnostic de l’azoospermie
Le diagnostic d’azoospermie ne peut être porté qu’après la réalisation de deux spermogrammes espacés de trois mois. Lors de chaque analyse, il est impératif de centrifuger le liquide séminal et d’examiner le culot à la recherche de spermatozoïdes, d’abord en microscopie directe entre lame et lamelle, puis après coloration.
Bon à savoir :
Cet examen s’inscrit dans le bilan diagnostique de l’infertilité du couple, évaluant notamment le nombre de spermatozoïdes viable.
- Oligozoospermie légère : Concentration en spermatozoïdes entre 5 et 14 millions/mL.
- Oligozoospermie modérée : Concentration entre 1 et 5 millions/mL.
- Oligozoospermie sévère : Concentration inférieure à 1 million/mL.
- On parle d’azoospermie en cas d’absence total de spermatozoïdes.
Examens complémentaires
En cas de confirmation d’une azoospermie, un bilan étiologique demandé par votre gynécologue traitant est nécessaire pour :
- Identifier le type (obstructif ou sécrétoire) et la cause de l’azoospermie ;
- Évaluer la probabilité de récupération de spermatozoïdes dans un but de procréation médicalement assistée (PMA).
Biochimie du liquide séminal
Le dosage de certains biomarqueurs permet de localiser le site de l’atteinte dans les voies génitales masculines :
- Zinc, acide citrique, phosphatases acides : produits prostatiques ;
- Fructose : sécrété par les vésicules séminales ;
- L-carnitine, alpha-glucosidase : d’origine épididymaire.
Une diminution de ces marqueurs suggère une obstruction distale ou une agénésie du segment concerné, orientant vers une azoospermie obstructive.
Bilan hormonal
Les dosages sériques de FSH, testostérone, prolactine et inhibine B permettent de distinguer les étiologies sécrétoires des obstructives :
- Une FSH élevée reflète une altération testiculaire primaire (azoospermie sécrétoire) ;
- Une inhibine B diminuée confirme un déficit de la spermatogenèse.
Analyse cytogénétique
Un caryotype sanguin est indiqué devant une oligozoospermie sévère ( diminution marquée de la concentration spermatique) ou une azoospermie pour détecter des anomalies chromosomiques (ex. : syndrome de Klinefelter).
Recherche de microdélétions du chromosome Y
La détection de microdélétions dans les régions AZFa, AZFb et AZFc du chromosome Y est essentielle dans les azoospermies d’origine sécrétoire. Ces anomalies génétiques peuvent compromettre toute tentative de récupération spermatique et nécessitent un conseil génétique.
Dépistage des mutations du gène CFTR
Dans les azoospermies obstructives, notamment en cas d’absence congénitale bilatérale des canaux déférents (CBAVD), un dépistage des mutations du gène CFTR est recommandé. Si une mutation est identifiée chez le patient, un test génétique de la conjointe est requis pour prévenir la transmission de la mucoviscidose.
Échographie testiculaire et vésicoprostatique
L’échographie testiculaire et vésicoprostatique avec Doppler des vaisseaux spermatiques permet de rechercher une varicocèle ou une anomalie des voies excrétrices, susceptibles de perturber l’émission spermatique.
Prélèvements chirurgicaux
En cas d’azoospermie, une ponction épididymaire (PESA) ou une biopsie testiculaire (TESE) peut permettre de recueillir des spermatozoïdes en vue d’une fécondation in vitro avec injection intracytoplasmique (ICSI), après cryoconservation éventuelle.
Traitement de l’azoospermie
Le traitement de l’azoospermie dépend de son étiologie (sécrétoire ou obstructive) et de la présence éventuelle d’autres altérations spermatiques.
Azoospermie obstructive (excrétoire)
Dans les formes obstructives, une reperméabilisation chirurgicale des voies excrétrices (anastomose épididymo-déférentielle ou vaso-vasostomie) peut être envisagée.
Azoospermie sécrétoire
Les azoospermies d’origine testiculaire sont plus complexes à traiter. Une substitution hormonale peut être indiquée en cas d’hypogonadisme hypogonadotrope (FSH/LH basses), par administration de gonadotrophines (hCG, hMG). En l’absence de déficit hormonal, le pronostic de récupération spermatique est réservé.
Azoospermie secondaire
Dans les azoospermies induites par un agent médicamenteux ou toxique (chimiothérapie, androgènes exogènes, etc.), l’arrêt de l’agent causal peut permettre une reprise de la spermatogenèse, généralement après plusieurs mois, en fonction du cycle spermatogénétique.
Traitement de la Varicocèle
La présence d’une varicocèle cliniquement significative, associée à une altération des paramètres spermatiques, peut justifier une varicocélectomie (chirurgie de ligature des veines spermatiques), susceptible d’améliorer la spermatogenèse.
Assistance médicale à la procréation (PMA)
En l’absence de récupération spermatique spontanée ou après échec des traitements étiologiques, le recours à la PMA est indiqué.
La fécondation in vitro avec injection intracytoplasmique de spermatozoïde (FIV-ICSI) constitue la méthode de choix dans l’infertilité masculine sévère. Elle permet la micro-injection d’un spermatozoïde unique dans l’ovocyte, même en cas de très faible nombre de gamètes viables, obtenus par ponction testiculaire (TESE) ou épididymaire (PESA).
Cette technique est également recommandée :
- En cas d’échec de FIV conventionnelle ;
- Lors de tératozoospermie sévère ou d’asthénozoospermie majeure
- En présence d’anticorps anti spermatozoïdes entraînant leur inactivation ou destruction.

